Cục Quản lý Dược (Bộ Y tế) vừa ban hành Quyết định số 30/QĐ-QLD ngày 13/01/2026 về việc đình chỉ lưu hành, thu hồi sản phẩm mỹ phẩm đối với sản phẩm mỹ phẩm có chứa chất Miconazole; Miconazole nitrate.
Cụ thể, đình chỉ lưu hành, thu hồi trên toàn quốc tất cả các lô còn hạn sử dụng đối với 8 sản phẩm mỹ phẩm tại Danh mục kèm theo Quyết định này, bao gồm các loại dầu gội, bọt vệ sinh và dung dịch vệ sinh phụ nữ, gồm:
Nhóm sản phẩm của Công ty Cổ phần Dược phẩm TEDIS - Việt Hà, gồm 2 sản phẩm: Biorga Cystiphane Normalizing Anti-Dandruff Shampoo S (Số phiếu công bố 142455/21/CBMP-QLD) và Biorga Cystiphane Intensive Anti-Dandruff Shampoo DS (Số phiếu công bố 143963/21/CBMP-QLD).
Sản phẩm của Công ty TNHH Thương mại HKK: Sản phẩm Piajour Woman Body Foam (Số phiếu công bố 268004/25/CBMP-QLD).
Nhóm sản phẩm của Công ty TNHH Thương mại và Xuất nhập khẩu BIOPHAR Việt Nam, gồm 2 sản phẩm dầu gội Dermavia Egeria Minazole Anti-Dandruff Shampoo với các số phiếu công bố 270385/25/CBMP-QLD và 273704/25/CBMP-QLD.
Nhóm sản phẩm của Công ty Cổ phần Dược Hậu Giang, gồm 3 sản phẩm: MicoFem Silk (Số phiếu công bố 297223/25/CBMP-QLD), MicoFem Bloom (Số phiếu công bố 297224/25/CBMP-QLD) và MicoFem Calm (Số phiếu công bố 297225/25/CBMP-QLD).
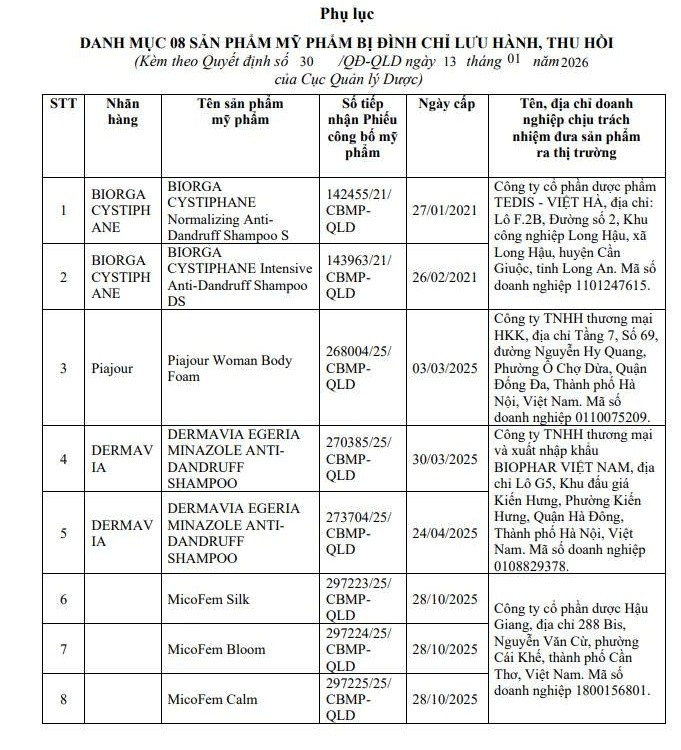 Danh mục 8 sản phẩm bị thu hồi/Ảnh chụp màn hình
Danh mục 8 sản phẩm bị thu hồi/Ảnh chụp màn hình
Lý do thu hồi nhằm tuân thủ quy định tại Hiệp định ASEAN về mỹ phẩm đối với việc đình chỉ lưu hành, thu hồi sản phẩm theo Kết luận của Hội đồng mỹ phẩm ASEAN tại kỳ họp lần thứ 42 ngày 20-21/11/2025 và Biên bản họp Hội đồng Khoa học mỹ phẩm ASEAN lần thứ 42 ngày 17-18/11/2025 đối với sản phẩm mỹ phẩm có chứa chất Miconazole; Miconazole nitrate.
Quyết định này có hiệu lực kể từ ngày ký ban hành. Các công ty gồm: Công ty Cổ phần Dược phẩm TEDIS - Việt Hà; Công ty TNHH Thương mại HKK; Công ty TNHH Thương mại và Xuất nhập khẩu BIOPHAR Việt Nam, Công ty Cổ phần Dược Hậu Giang phải gửi thông báo thu hồi tới những nơi phân phối, sử dụng các sản phẩm tại Danh mục kèm theo Quyết định này do công ty đưa ra lưu thông; tiếp nhận sản phẩm trả lại từ các cơ sở kinh doanh và tiến hành thu hồi, tiêu hủy toàn bộ sản phẩm. Gửi báo cáo thu hồi, tiêu hủy các sản phẩm nêu trên về Cục Quản lý Dược trước ngày 12/02/2026.

Quyết định thu hồi của Cục Quản lý Dược/Ảnh chụp màn hình
Cục Quản lý Dược đề nghị Sở Y tế các tỉnh, thành phố thông báo cho các cơ sở kinh doanh, sử dụng mỹ phẩm trên địa bàn ngừng ngay việc kinh doanh, sử dụng các sản phẩm mỹ phẩm vi phạm và trả về cơ sở cung ứng sản phẩm; giám sát các đơn vị thực hiện thông báo này. Phối hợp với các cơ quan truyền thông thông tin tới các cơ sở buôn bán, sử dụng mỹ phẩm và người dân biết để không buôn bán, sử dụng các sản phẩm mỹ phẩm nêu trên; Xử lý các tổ chức, cá nhân vi phạm theo quy định hiện hành và báo cáo kết quả về Cục Quản lý Dược.
Sở Y tế các tỉnh/thành phố Hà Nội, Cần Thơ, Tây Ninh giám sát các công ty tại Danh mục kèm theo Quyết định này đóng trên địa bàn thực hiện việc thu hồi, tiêu hủy các sản phẩm và Báo cáo kết quả kiểm tra, giám sát về Cục Quản lý Dược trước ngày 02/03/2026. Quyết định này có hiệu lực kể từ ngày ký ban hành. Giám đốc công ty có tên tại Danh mục nêu trên và Giám đốc Sở Y tế các tỉnh, thành phố chịu trách nhiệm thi hành Quyết định này.


![[INFOGRAPHIC]Morefine M900, Mini PC dáng Mac mini, RAM 96GB](https://cdn.khoahocdoisong.vn/images/43b54213f417a734df7abfbb0783ad3a5b24a4932c186cffeb4f56b6d75c473055b62d4623cba621b3887a4ea2ff324e6b58b6467b815ad4955e760bf0dcc0fe/thumb-mini-pc-5-1.jpg.webp)



